香港大学深圳医院临床试验机构设立在临床试验中心(Clinical Trials Center,CTC),作为院内跨学科、跨部门、具有一定管理职能的独立机构,为医院I-IV期药物临床试验、医疗器械临床试验及体外诊断试剂临床试验提供专门管理和服务。CTC于2015年7月成立,在医院临床试验机构管理委员会(CTC-COM)指导下负责临床试验的具体管理工作。医院作为已经认定及备案的国家药物/器械临床试验机构(以下简称“机构”),由CTC行使GCP机构办公室的职能,配备专职人员负责具体管理工作。
目前全院共计25个专业具备药物临床试验开展资格,35个专业具备医疗器械临床试验开展资格。2018年6月,中心获批深圳市发改委药物临床试验公共服务平台组建项目,项目资金1300万。
医院作为全国首家指定“港澳药械通”试点医疗机构、国家“委省共建高质量发展试点医院”及中国内地唯一一家获得三甲医院及ACHS双认证医疗机构、广东省首批高水平医院建设单位,高度重视临床试验及生物医药科研发展,在借鉴香港大学临床试验中心(HKU-CTC)逾20年的国际化管理经验,秉承对试验质量的高度追求,致力于发展为国内一流、区域领先、国际知名的一站式临床试验管理服务平台。
一、机构资质
1.国家药物临床试验机构
医院先后于2017年5月及2019年10月顺利通过国家药物临床试验机构(GCP)资格认定及新增专业检查。2019年11月29日,国家药品监督管理局、国家卫生健康委联合发布《药物临床试验机构管理规定(2019年101号)》,GCP资格认定由现场检查改为备案制。我院主动响应、认真研究、积极筹备,并于2019年12月6日率先完成药物临床试验机构备案工作,是深圳市第一家、广东省第三家、全国第十五家完成备案的医疗机构。2021年新增5个专业并于2021年8月4日顺利通过广东省药监局检查,目前药物备案专业共25个:
备案编号 | 药临床机构备字2019000015 |
备案专业
| 呼吸内科专业、消化内科专业、神经内科专业、心血管内科专业、血液内科专业、肾病学专业、内分泌专业、免疫学专业、普通外科专业、骨科专业、生殖健康与不孕症专业、新生儿专业、小儿血液病专业、皮肤病专业、肿瘤科、 妇科专业、I期临床试验研究室-I期药物临床试验、I期药物临床试验研究室-生物等效性试验、小儿骨科专业、心脏大血管外科、神经外科、胸外科、泌尿外科、重症医学科、全科医疗科 |
国家公告 网址 | 药物和医疗器械临床试验机构备案系统 (https://beian.cfdi.org.cn/CTMDS/apps/pub/public.jsp) |
资质证书 |   
|
2.国家医疗器械临床试验机构
医疗器械GCP备案专业共35个:
备案编号 | 械临机构备201800078 |
备案日期 | 首次:2018年4月20日 |
备案专业 | 呼吸内科专业、消化内科专业、神经内科专业、心血管内科专业、血液内科专业、肾病学专业、内分泌专业、免疫学专业、普通外科专业、神经外科专业、骨科专业、泌尿外科专业、心脏大血管外科专业、胸外科、妇科专业、优生学专业、生殖健康与不孕症专业、新生儿专业、小儿血液病专业、小儿骨科专业、耳鼻咽喉科、口腔科、皮肤科、美容皮肤科、肿瘤科、麻醉科、重症医学科、临床微生物学专业、病理科、X线诊断专业、CT诊断专业、磁共振成像诊断专业、介入放射学专业、放射治疗专业、中医科 |
国家公告网址 | 药物和医疗器械临床试验机构备案系统 (https://beian.cfdi.org.cn/CTMDS/apps/pub/public.jsp) |
二、组织架构
中心由机构管理组、质量管理组、项目管理组、GCP中心药房、研究型病房(I期)和培训及发展平台组成。现有8名专职人员,包括办公室主任、药物临床试验秘书、器械临床试验秘书、质量管理员、资料管理员、财务管理员、临床试验药师等。组织架构如下:
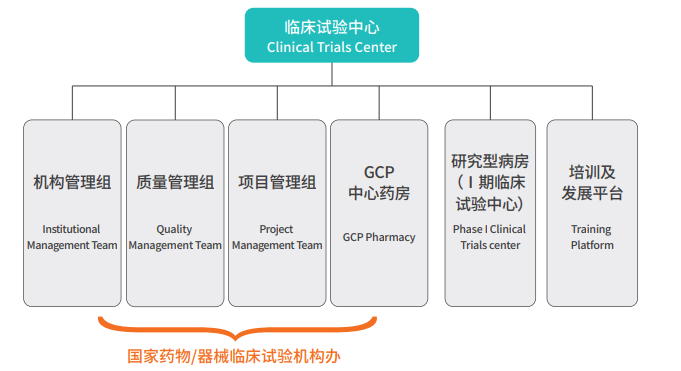
图1 组织架构
三、工作职责
临床试验中心(CTC)是我院负责I-IV期药物、医疗器械、体外诊断试剂等临床试验专业化管理及服务的部门,同时,承担着国家药物临床试验机构办公室(简称“机构办”)的工作,工作职责包括:服务、协调、监管、培训4大模块。
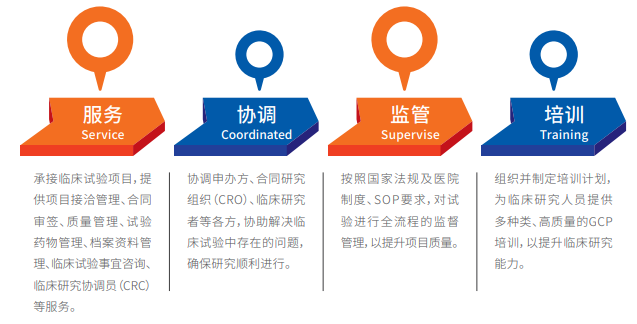
图2 工作职责
四、业务范围及服务
1、HKU-SZH CTC主要业务管理范围包括:
(1)I~IV期药物临床试验
(2)医疗器械临床试验
(3)体外诊断试剂临床试验
(4)港澳药械通”真实世界研究(RWS)
(5)申办方发起的上市后再评价研究
2、提供一站式临床试验管理及服务:
(1)试验开展前协调与接洽、可行性评估、立项管理、合同审核及管理;
(2)试验支持性服务:中心化药物管理、协助研究计划制定、院内CRC服务、I期临床试验服务等;
(3)试验实施阶段的管理服务:项目质量管理、药物管理、费用管理、SMO-临床研究协调员服务管理、CRA监查管理、生物样本管理等
(4)研究资料归档储存管理;
(5)专业培训(如GCP培训、CRC培训、研究启动培训等)
机构始终将试验质量作为开展工作的基石,项目100%于结题前完成质控。自2017年获GCP资质以来,CTC已与国际国内申办者推动了超过80项临床试验。在历次接受国家药品监督管理局、省级药监管理部门针对机构及项目的检查、申办方针对试验的稽查过程中均无发现严重问题,质量得到有效保障。
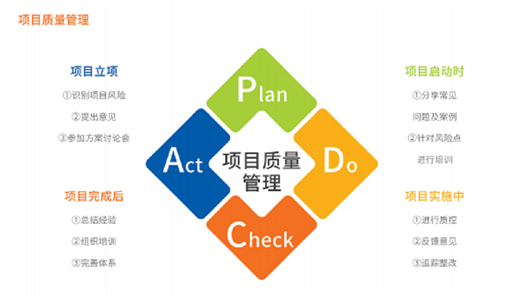
图3 项目质量管理
五、基本情况展示
1、完善的功能分区
功能分区 | 位置 | 主要功能 | 设施设备 |
办公室 | 科教管理楼 6楼1619室 | 日常办公 对外接待 | 配置内外网电脑、打印复印传真一体机、会议桌、碎纸机、投影仪等必备办公用品,配备带密码锁的文件柜,用以存放在研的临床试验项目资料。 |
临床试验专用药房 | 住院部C栋 6楼西区 | 对I-IV期药物临床试验的试验用药品进行中心化管理 | 配置2-8℃药品储存柜、8-20℃药品阴凉柜、15-25℃药品恒温柜、智能化麻精药品保险柜、生物安全柜, 24h温湿度冷链监控系统。 |
临床试验专用档案室 | 科教管理楼 7楼 | 对已结题的临床试验项目档案进行中心化管理 | 配备双门文件柜,专人管理,配备温湿度计、除湿机、空调、灭火器、计算机及网络等。 |
2、健全的制度SOP体系
类别(机构层面) | 数量 |
全院管理制度 | 6项 |
内部管理制度 | 10项 |
应急预案 | 1项 |
设计规范 | 5项 |
标准操作规程 | 32项 |
工作指引 | 11项 |
临床临床试验中心严格按照临床试验的相关法规及我院制度/SOP对我院临床试验进行管治。目前CTC已建立覆盖临床试验全过程的管理制度、标准操作规程和设计规范,共计65项,全部制度均需通过培训后方可生效执行,保证医务工作者知悉后参照执行。针对各GCP专业科室的制度SOP,由CTC进行审核后各科室签批培训后生效。
此外,CTC组织编撰《临床试验常用专业术语及法规手册》及《临床试验常用制度及SOP汇编》,便于医务工作者、机构人员及研究者学习查阅。

图4 制度及SOP汇编
3. 主题丰富的GCP培训
CTC定期联同国内及境外知名学术机构(如香港大学临床试验中心、广东省药学会等)举办国际国内GCP培训及工作坊。同时推广由香港大学临床试验中心发起的GCP培训平台-TRREE。目前全院临床研究者均参与GCP培训并获得培训证书。

图5 GCP培训







 搜索
搜索























 备案号
备案号